<div style="position: relative; width: 300px; height: 197px;"><a href="https://phet.colorado.edu/sims/build-a-molecule/build-a-molecule_es.jnlp" style="text-decoration: none;"><img src="https://phet.colorado.edu/sims/build-a-molecule/build-a-molecule-600.png" alt="Construye una molécula" style="border: none;" width="300" height="197"/><div style="position: absolute; width: 200px; height: 80px; left: 50px; top: 58px; background-color: #FFF; opacity: 0.6; filter: alpha(opacity = 60);"></div><table style="position: absolute; width: 200px; height: 80px; left: 50px; top: 58px;"><tr><td style="text-align: center; color: #000; font-size: 24px; font-family: Arial,sans-serif;">Click para iniciar</td></tr></table></a></div>
quimicainorgánica1
domingo, 17 de abril de 2016
sábado, 23 de enero de 2016
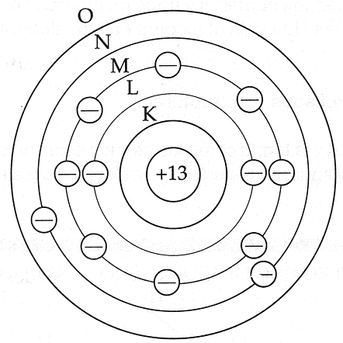
Niveles de energía de un átomo

Utilizar pinturas para identificar los niveles o capas, como está en el gráfico
Fuente:http://www.monografias.com/trabajos103/modelos-atomicos-y-estructura-atomica
miércoles, 13 de enero de 2016
Modelo planetario de Bohr
Modelo de Bohr
Bohr definió las órbitas con letras que iban desde la K en adelante, siendo K la órbita de menor energía, tal y como lo muestra la Imagen 6.
Lamentablemente este modelo solo sirvió para los átomos del tipo hidrogenoides, siendo muy deficiente para los átomos polielectrónicos (solo pudo determinar la cantidad máxima de electrones por nivel con la fórmula 2n^2 [considerando que K = 1, L = 2, M = 3 y N = 4.]).
Para solucionar este problema, Niels Bohr, aplico la teoría cuántica de Max Planck, la cual decía que la energía estaba "cuantizada", es decir, que absorbía o liberaba pequeños paquetes de energía, llamados cuantos, al modelo planetario de Rutherford, generando un nuevo modelo atómico, denominado modelo atómico estacionario, el cual decía que:
- La energía del electrón está cuantizada.
- El electrón se mueve alrededor del núcleo en un nivel de energía estacionario, en donde, mientras se encuentre en él, no perderá ni ganará energía. Este nivel se encontrará lo más cercano al núcleo que le sea posible.
- Cuando un electrón gana energía, salta del nivel estacionario a un nivel de mayor energía. Cuando el electrón vuelva a su nivel basal o estacionario liberará la energía sobrante en forma de luz.
- Las órbitas donde se encuentran los electrones son circulares.
Bohr definió las órbitas con letras que iban desde la K en adelante, siendo K la órbita de menor energía, tal y como lo muestra la Imagen 6.
Lamentablemente este modelo solo sirvió para los átomos del tipo hidrogenoides, siendo muy deficiente para los átomos polielectrónicos (solo pudo determinar la cantidad máxima de electrones por nivel con la fórmula 2n^2 [considerando que K = 1, L = 2, M = 3 y N = 4.]).

Fuente: http://es-puraquimica.weebly.com/bohr.html
martes, 22 de diciembre de 2015
Características de los metales y no metales
Los no metales varían mucho en su apariencia no son lustrosos y por lo general son malos conductores del calor y la electricidad. Sus puntos de fusión son más bajos que los de los metales. Varios no metales existen en condiciones ordinarias como moléculas diatómicas. En esta lista están incluidos cinco gases (H2, N2, 02, F2 y C12), un líquido (Br2) y un sólido volátil (I2). El resto de los no metales son sólidos que pueden ser duros como el diamante o blandos como el azufre. Son muy frágiles y no pueden estirarse en hilos ni en láminas. Se encuentran en los tres estados de la materia a temperatura ambiente: son gases (como el oxígeno), líquidos (bromo) y sólidos (como el carbono). No tienen brillo metálico y no reflejan la luz. Muchos no metales se encuentran en todos los seres vivos: carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre en cantidades importantes. Otros son oligoelementos: flúor, silicio, arsénico, yodo, cloro.
a mayor parte de los elementos metálicos exhibe el lustre brillante que asociamos a los metales.
Los metales conducen el calor y la electricidad, son maleables (se pueden golpear para formar láminas delgadas) y dúctiles (se pueden estirar para formar alambres). Todos son sólidos a temperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC), que es un líquido. Dos metales se funden ligeramente arriba de la temperatura ambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchos metales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a 1900 ºC.
Fuente: http://cuadrosinoptico.info/cuadros/cuadro-comparativo-metales-y-no-metales/
a mayor parte de los elementos metálicos exhibe el lustre brillante que asociamos a los metales.
Los metales conducen el calor y la electricidad, son maleables (se pueden golpear para formar láminas delgadas) y dúctiles (se pueden estirar para formar alambres). Todos son sólidos a temperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC), que es un líquido. Dos metales se funden ligeramente arriba de la temperatura ambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchos metales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a 1900 ºC.
Fuente: http://cuadrosinoptico.info/cuadros/cuadro-comparativo-metales-y-no-metales/
viernes, 4 de diciembre de 2015
Grupos y períodos de la tabla periódica
Los grupos de la Tabla Periódica, numerados de izquierda a
derecha son:
Grupo 1 (IA): los metales alcalinos
Grupo 2 (IIA): los metales alcalinotérreos
Grupo 3 al Grupo 12: los metales de transición,
metales nobles y metales mansos
Grupo 13 (IIIA): Térreos
Grupo 14 (IVA): carbonoideos
Grupo 15 (VA): nitrogenoideos
Grupo 16 (VIA): los calcógenos o anfígenos
Grupo 17 (VIIA): los halógenos
Grupo 18 (Grupo VIII): los gases nobles
Períodos de la tabla periódica
Las filas horizontales de la Tabla Periódica son
llamadas Períodos. Contrario a como ocurre en el caso de los grupos de la tabla
periódica, los elementos que componen una misma fila tienen propiedades
diferentes pero masas similares: todos los elementos de un período tienen el
mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca de
acuerdo a su configuración electrónica. El primer período solo tiene dos
miembros: hidrógeno y helio, ambos tienen solo el orbital 1s.
La tabla periódica consta de siete períodos:
Período 1: comprende solo dos elementos:
hidrógeno (Z=1) y helio (Z=10), son los dos elementos gaseosos más ligeros que
se encuentran en la naturaleza.
Período 2: consta de ocho elemento; comienza con
el litio (Z=3) y termina con el neón (Z=10). En este período se ubica el
oxígeno y el nitrógeno, gases fundamentales en la composición del aire que
respiramos, y el carbono, materia prima fundamental de los seres vivos.
Período 3: tiene igualmente ocho elementos; se
inicia con el sodio (Z=11) y termina con el argón.
Período 4: comprende un total de 18 elementos,
comienza con el potasio (Z=19) prolongándose hasta el kriptón (Z=36). En este
periodo se encuentran metales como el titanio, el cromo, el hiero, el cobalto,
el níquel, el cobre y el zinc ampliamente utilizados en la industria.
Período 5: también con 18 elementos, comienza
con el rubidio (Z=37) hasta el xenón (Z=54). En esta serie se destaca el yodo
por su valor biológico.
Período 6: con 32 elementos, se inicia con el
cesio (Z= 55) y termina en el radón (Z= 56). Se destaca el oro y el platico
como metales preciosos y el mercurio que es el único metal liquido que existe
en la naturaleza.
Dentro de este período hay un conjunto
particular de 14 elementos, comenzando con el cesio (Z= 58) y terminando con el
lutecio (Z=71) llamados series de los lantánidos. Se ubican generalmente al
final de la tabla en una fila aparte; son metales que se hallan en minerales
raros como la euxenita.
Período 7: se extiende desde el francio (Z= 87)
hasta el elemento 109, unilenio, este periodo incluye como el anterior un
conjunto de 14 elementos, desde el torio (Z= 90) hasta el unilenio (Z= 109),
llamados series de actínidos porque sus propiedades son similares al actinio.
Se ubican al igual que los lantánidos en la parte inferior de la tabla
periódica.
viernes, 27 de noviembre de 2015
Métodos de separación de componentes de una mezcla
Sabemos que la mezcla es la unión física de dos o más substancias (elementos o compuestos) que al hacerlo conservan sus propiedades individuales y que existen mezclas homogéneas y heterogéneas. La composición de las mezclas es variable y sus componentes podrán separarse por medios físicos o mecánicos.
LA DECANTACIÓN. Es un método utilizado para separar un sólido, de grano grueso e insoluble, de un líquido. Consiste en esperar que se sedimente el sólido para poder vaciar el líquido en otro recipiente.

DECANTACIÓN DE LÍQUIDOS. Este método se utiliza para la separación de dos líquidos no miscibles y de diferentes densidades, utilizando un embudo de decantación. Este método es aplicado en la extracción de petróleo en yacimientos marinos la cual separan el petróleo, al ser menos denso, quedando en la parte superior del agua. El petróleo se almacena y el agua es devuelta al mar.

LA FILTRACIÓN. Con este método se puede separar un sólido insoluble de grano relativamente fino de un líquido. En este método es indispensable un medio poroso de filtración que deja pasar el líquido y retiene el sólido. Los filtros más comunes son: papel filtro, redes metálicas, fibra de asbesto, fibra de vidrio, algodón fibras vegetales y tierras especiales.

LA CENTRIFUGACIÓN. Es un método utilizado para separar un sólido insoluble de grano muy fino y de difícil sedimentación de un líquido. Esta operación se lleva a cabo en un aparato llamado centrífuga, en el que aumenta la fuerza gravitación provocando la sedimentación del sólido.El plasma de la sangre puede separarse por este método.

viernes, 20 de noviembre de 2015
Suscribirse a:
Comentarios (Atom)