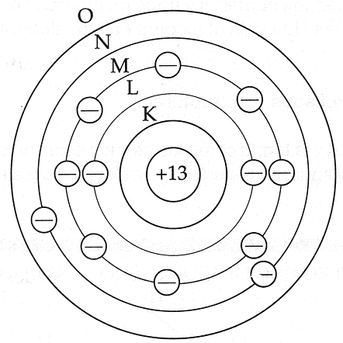
Modelo de Bohr
Para solucionar este problema, Niels Bohr, aplico la teoría cuántica de Max Planck, la cual decía que la energía estaba "cuantizada", es decir, que absorbía o liberaba pequeños paquetes de energía, llamados cuantos, al modelo planetario de Rutherford, generando un nuevo modelo atómico, denominado modelo atómico estacionario, el cual decía que:
- La energía del electrón está cuantizada.
- El electrón se mueve alrededor del núcleo en un nivel de energía estacionario, en donde, mientras se encuentre en él, no perderá ni ganará energía. Este nivel se encontrará lo más cercano al núcleo que le sea posible.
- Cuando un electrón gana energía, salta del nivel estacionario a un nivel de mayor energía. Cuando el electrón vuelva a su nivel basal o estacionario liberará la energía sobrante en forma de luz.
- Las órbitas donde se encuentran los electrones son circulares.
Bohr definió las órbitas con letras que iban desde la K en adelante, siendo K la órbita de menor energía, tal y como lo muestra la Imagen 6.
Lamentablemente este modelo solo sirvió para los átomos del tipo hidrogenoides, siendo muy deficiente para los átomos polielectrónicos (solo pudo determinar la cantidad máxima de electrones por nivel con la fórmula 2n^2 [considerando que K = 1, L = 2, M = 3 y N = 4.]).
Fuente: http://es-puraquimica.weebly.com/bohr.html